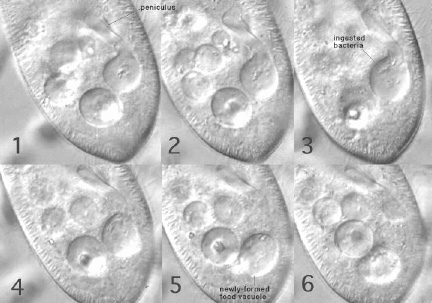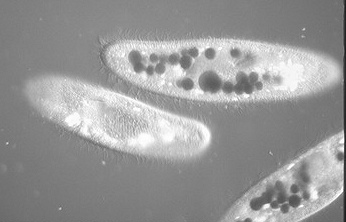
カーミン顆粒を食胞に取り込んだ細胞(右上&下)と透明な細胞の間での交配反応(繊毛どうしの接着)
ゾウリムシは形で雌雄(接合型の違い)は区別できないため,人為的に識別しやすいように片方に赤い色素であるカーミンの粉末を取り込ませた。このほか,片方をアカエンドウマメ培養液(後述)で培養し,他方をキナコの浸出液で培養することで細胞質の透明度を変えて識別する方法もある。
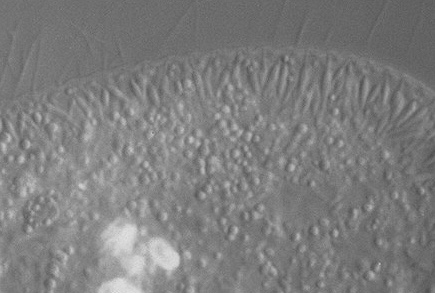
ゾウリムシ生細胞の細胞表層の光学顕微鏡像
細胞表層を見ると鞭毛の基部と基部の間から紡錘形の構造が規則的に配置されているのが見える。これがトリコシスト(刺胞)である。また,その下方に球状の構造が多数見えるが,これらがゾウリムシのミトコンドリアである。