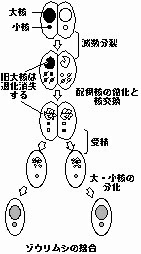
核変化のステージを事前に理解しておく
1. 小核の減数分裂 前期 中期 後期
2. 配偶核の有糸分裂
3. 雌雄性核(移動核・静止核)の分化
4. 核交換 受精(新世代の誕生)
5. 受精核の分裂 大核小核の分化
6. 大核の断片化,退化
| 原生生物の採集と観察 |
| もどる | 目 次 | おわり |
6 補 遺
3:ゾウリムシ接合過程の核変化の観察
|
所要時間
接合過程をステージ(上記の1〜6)ごとに染色・観察する場合は,接合過程全体が完了するまでに 24時間以上かかるので,接合を開始させるスケジュールに注意する必要がある。あらかじめ適当に時間をずらして接合を開始させ(=雌雄の細胞株を混ぜ合わせる),染色時に,同時に異なるタイムコースのサンプルが得られるようにする。 |
|
接合に適した培養法
レタスジュース(またはアカエンドウマメ抽出液)などを滅菌した培養液が望ましい。なぜなら,接合を観察するには,高い「接合活性」をもった細胞(=接合活性のある細胞の割合の多い細胞集団)を入手する必要があるが,そのためには培養の増殖期と定常期がハッキリ区別できる培養条件が必要だからである。固形物が混じるキナコ培養等では,増殖期と定常期の境が曖昧で,いつから接合活性が出るかを予測しずらい。(特に増殖速度の異なる株を用いる場合,条件を揃えるのが困難。)その点,レタスやアカエンドウでは,細胞の増殖期は培養液が濁り,定常期に達すると透明に変わるので,細胞の生理条件が整いやすく,いっせいに接合活性を出すようになる。 また,通常は培養条件が整いやすい試験管培養を行うが,この場合は,餌は与えすぎないようにするのがコツである。餌(餌となるバクテリアを接種して一日以上おいた培養液)を与えた翌日には餌をおおよそ食べ尽くすくらいが一番よい。この条件で培養を続けていくと,給餌した翌日には大部分の細胞が接合型活性を示すようになる(ただし,成熟期に達している細胞のみ(注))。接合活性は温度が高すぎたり,雑菌の混入によっても失活することがあるので注意が必要である。ただし,雑菌の混入はすべて悪いというわけではない。培養の定常期に達しても培養液が白くにごるようだと接合活性の出現は期待できないが,その他の場合は雑菌があってもあまり影響しないことも多い。 注:一般的な接合型活性の出現条件としては,成熟株であること,培養の定常期,かつ, 古過ぎない(老化していない)ことなどがあげられる。 |
|
準備するもの
試薬類 カルノア(エタノール:酢酸=3:1) 細胞固定用 6N塩酸 細胞質にあるRNAを除去する 水 試薬除去用 染色液(アズールC水溶液) 塩基性色素なら他でもよい(0.5〜1 mg/ml程度) 染色液(ファストグリーン水溶液) 細胞質を染める(0.1 mg/ml程度) エタノール 包埋前の処理用 キシロール 包埋直前に用いる *各々の試薬を入れるための染色用バット(ガラス製)も必要。
プレパラートの作成用試薬および器材 |
|
本 番
ステップ 1:接合の誘導 高率に接合対を形成させる。 クランプに参加していないものを取り除く=上澄みを減らす 同調して接合を! 途中でクランプから抜け出したものを除く, サンプリングの際の注意。 0〜3時間目までは接合対は離れ易い。 同調してないと意味ない。 ステップ 2:プレパラートの作成 a) 試料の塗布・乾燥 細胞の形をくずさず,大量の細胞を均一に! 観察し易くするためには,ある程度の細胞密度が必要 藤島法が最適 b) 風乾 1.手回し遠心機による細胞の濃縮 ミニ遠心管が必要 長いパスツールピペットも 2.スライドガラスへの張り付け・乾燥 ステップ 3:固定・染色 ここでは簡易法として,アズールC+ファストグリーン法を用いる。
手順 |
| もどる | 目 次 | おわり |
| 原生生物の採集と観察 |