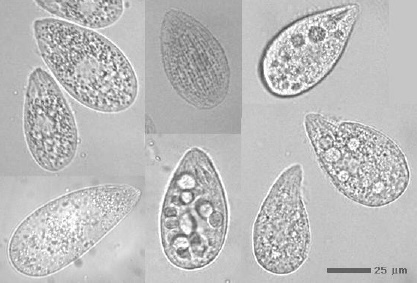
テトラヒメナ(Tetrahymena)
無菌培養による大量培養が容易なため,古くは生理・生化学分野の研究材料として利用された。その後,遺伝学の材料としての研究が進み,今日では世界中で広く利用されている。
| 原生生物の採集と観察 |
| もどる | 目 次 | すすむ |
5 アメーバの培養と観察
2)培養法
| アメ−バ・プロテウス(Amoeba proteus)の培養には,原生生物繊毛虫(テトラヒメナ,ゾウリムシ等)や,鞭毛虫(キロモナス等)を餌として用いる。 |
| a. テトラヒメナによる培養 |
|
文 献
Prescott, D.M. & James, T.W., Exptl. Cell Res. 8: 259- (1955) Prescott, D.M., Exptl. Cell Res. 9: 328- (1955) Griffin, J.L., Exptl. Cell Res. 21: 170- (196?) つぎに,このテトラヒメナを使った培養法を通常の培養と,短期間に大量培養する場合とに分けて紹介する。 |
|
通常の培養法(室温での維持)
通常は,2〜3日に一度位の頻度で餌を与える。あらかじめ餌を与える前に汚れた培養液の上半分くらいを捨てて(このときアメーバは底にいる),新しい塩溶液を補充してから餌を与える。テトラヒメナは,KCM塩溶液で洗ってから一日に食べつくせるくらいの量を与える。 |
|
実験に使用する際の培養法
実験の際には,早く,生理的条件の整った細胞が大量に必要になる。この方法はそのような要求にあった培養法である。上記の方法でも大量培養は可能だが,できるかぎり早く細胞の増殖を促し,かつ細胞の生理的状態を揃えるには,以下のような方法をとる。 この方法の「通常の培養法」との違いは,最初に培養液の交換をせず,餌を先に与えることにある。餌を与えた後,満腹になった細胞がシャーレの底にかたく接着する性質を利用して,その時点で,食べ残したテトラヒメナを残った培養とともにすべて捨ててしまう。その後,新鮮な培養液を与える。これにより,そこには満腹のアメーバと汚れていない培養液だけが残る。 この方法では,餌を満腹になるまで食べさせた後,いっせいに餌を取り除いてしまうので,細胞の生理的条件が揃いやすい。また,この方法では培養液が毎日完全に新鮮なものと交換するので,汚れの影響を排除できる。このためアメーバは培養液の汚れという「環境抵抗」を受けずに増殖を続け,やがてシャーレ全面を被うくらいに数が増える。ただし,テトラヒメナによる培養は,増殖速度が早いと同時に,餌をあたえないでおくと,飢餓状態になり弱るのも速い。また,細胞密度が高いと細胞からでる老廃物などにより培養液が汚れやすくなる。室温では4〜5日以上培養液を交換せず餌も与えないでおくのは,危険である。 |
|
材 料 培養用容器: シャ−レ(通常は12 cm 前後のものを用いる。クロ−ニングなどを行なう場合は,デプレッションスライドなど小型の穴のなかで培養し,ある程度数が増えた時点で,小型のシャ−レ,中型のシャ−レと,順々にサイズを大きくしていく。)
培養用塩溶液:
KCM 100倍原液 |
|
方 法
アメ−バは培養液の汚れに対して極端に敏感なので,過剰に加えた餌は,早目に取り除くことが望ましい。このためには,アメ−バの摂食の最中,および直後は,接着性が増し,かなり強くシャ−レのガラス底に着く性質を利用する。 |
|
1)餌の準備
テトラヒメナは,三角フラスコで培養したもの(*)を,上記の塩溶液で洗い適当に希釈する。この際,植え継いでから時間が立ち過ぎたものは用いない(植え継ぎから10日が限度)。また,テトラ細胞を集めるのに強い遠心をしないよう注意する。培養が古かったり,遠心が強いすぎると,死ぬ細胞が多くなる。これらがシャ−レの中で溶解すると,アメ−バがガラス底に接着しなくなるので,あとで培養液の交換を行なうのが難しくなる。 *:例えば,300〜500 mlの三角フラスコ(平底)に30〜50 ml程度のPPYG培養液を入れて培養する。空気と触れる面積を大きくとることで,酸欠が起こらないようにする。さもないと培養中に細胞の死骸が混じりアメーバ用の餌としては使いものにならなくなる。 2)培養器の交換 飢餓状態のアメーバは,シャーレの底にいても底部への接着性は弱い。そこで,シャーレを軽くたたいて細胞を遊離させ,汚れた培養液のまま新しい別のシャーレへ移し替える。 |
| ただし,アメ−バの数が多い場合,あるいは,培養の状態が良好でない場合は,一部のアメ−バは,摂食をしないか,あるいは,摂食した後も浮遊したままでいることがある。その場合は,余分であれば,培養液の交換の際に一緒に捨てればよいが,捨てないで使いたいという時は,細胞の一部をいったん他のシャ−レに移して,新しい塩溶液を加える。細胞密度が高すぎてうまく接着できなかっただけであれば,ただちに接着するので,接着後,新ためて培養液の交換を行なえばよい。しかし,細胞が弱っていて接着できないのであれば,シャ−レを替えても接着できないので,その際はあきらめて捨てる。 |
|
**アメ−バを早く増やしたいときは,給餌および培養液の交換を毎日行なうが,そうでなければ1日,2日おきでもかまわない。3日おきでもほぼ問題はないが,良好なコンディションで培養したいときは,少なくとも1日,2日おきには餌を与えたほうがよい。
**また,何日かすると,シャ−レの底が老廃物や雑菌の繁殖により汚れてくる。底の汚れは培養液の汚れに比べてアメーバへの悪影響はない。したがって,アメ−バのコンディションが良い場合は,多少汚れても特に頻繁にシャ−レ交換をする必要はない。しかし,アメ−バの死骸が混じってきたり,正常な浮遊型でないものがたくさんでている場合は,早目にシャ−レを新しいものと交換したほうがよい。 シャ−レの交換は,餌を与える前に行なう。前述したように,空腹時のアメーバは底への接着性が弱いのでシャ−レを軽くたたけば底にくっついているものを浮遊させることができる。そうして,すべてのアメ−バを汚れた培養液とともに新しいシャ−レに移しかえる。その後,餌(テトラヒメナ等)を食べさせアメ−バが底に接着するのを待って,培養液の交換を行なう。 |
| つぎに,以前行なっていた方法で,米粒とキロモナスという鞭毛虫(クリプト藻類に含まれるが葉緑体はない)の一種を使った培養法を紹介する。これは簡易培養法の一種で,手間はかからないが,培養条件は培養器ごとに異なってしまい,安定しない。また,細胞密度も低いので通常の実験には利用しにくい。 |
| もどる | 目 次 | すすむ |
| 原生生物の採集と観察 |