反対側の端にはキャップを取り付けるが,キャップが外れないように端を膨らませておく必要がある。そのためには,反対側の端をバーナーで加熱して硬い物に押し付ければよい。こうすると簡単に膨らませることができる。
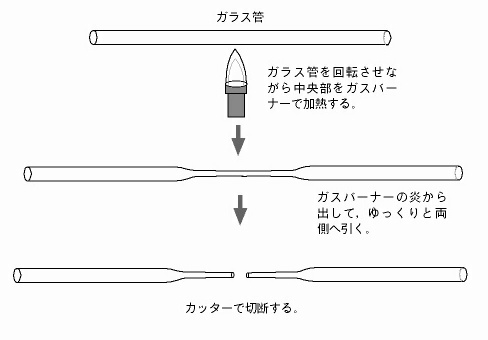
移植用ピペットの作り方
| 原生生物の採集と観察 |
| もどる | 目 次 | すすむ |
2 原生生物の観察法
|
原生生物を観察するには,採集サンプルをそのまま見る方法と,既述したように,採集サンプルに光を当てたり米粒を加えたりしてある程度培養してから見る方法,さらには,採集サンプルから細胞を単離・培養した上でそれをじっくりと観察する方法と大きく3通りの観察法がある(培養法については後述)。
いずれの場合も,採集サンプル中の原生生物をプレパラートに移して顕微鏡で観察するための基本となる操作を身につける必要がある。そこで,まず最初に原生生物を扱う上で欠かすことのできない基本操作から説明をしたい。 |
|
1)原生生物の扱い方
原生生物を扱う上で基本となるのが,双眼実体顕微鏡とピペットである。顕微鏡の扱い方については他に様々な解説書があるので,ここではピペットの作り方についてのみ紹介する。 ピペットには,移植用と単離用の2種類がある。移植用とは,肉眼で,培養器にあるサンプルの一部(多数の細胞を含む)を吸い取って他の容器に移すためのものである。一方,単離用のピペットはマイクロピペット(ミクロピペット)ともいい,実体顕微鏡の下で細胞を一つずつピペットの先端部に吸い込み,それを他の容器へ移したり,観察用のスライドグラスにごく微量のサンプルを乗せる時などに使用する。 この他,後述するように,単離操作の際には,各操作ごとにマイクロピペットを熱湯で簡易滅菌するために電気コンロとお湯を入れるためのビーカーが必要になる(3章)。ピペットに付着したバクテリアや他の原生生物が他の培養に混入しないように,連続して使用するピペット類は基本的に各操作ごとに滅菌処理を施す必要がある。 |
|
移植用ピペット
移植用には一般に長めのものが用いられるが,それらは自作する場合と市販品を利用する場合の2通りの選択肢がある。自作するのは手間がかかるが目的に応じてピペットの長さや先端部の径を自由に変えられるのが利点である。一方,市販品の場合は,手軽ではあるが,ほとんど長さが同じため場合によっては不便なこともある。
|
| 市販品としては様々なメーカーが製造している「パスツ−ルピペット」がある。ただし,市販のものは培養細胞等を扱うために製造されているもので,ガラス管の長さはどれもほぼ同じ長さである。試験管の底にいるゾウリムシを吸い取るといった作業には若干短すぎて不便なこともある。また使い捨て用として製造されているため,くり返して使うと壊れやすい。標準の2倍の長さのものもあるが,それは先の細い部分を伸ばしてあるだけなので,細い部分が折れやすく,移植用には適さない。 |
| マイクロピペット |
| デプレッションスライド |
| 原生生物の観察や単離操作などは実体顕微鏡下で行う。このため,実体顕微鏡に合った適当なサイズの透明容器が必要になる。ゾウリムシ研究者の間ではそのために専用に開発された特別のガラス容器,「デプレッションスライド」が使用されている。 |
 |
 中央にあるのが3つの丸い窪みのあるデプレッションスライド(東北大型)である。 |
| 細胞の集め方 |
|
通常,採集してきたサンプルは,そのままマイクロピペットでスライドガラスに乗せて観察することが望ましいが,浮遊性の原生生物に関しては,事前にある程度,細胞の密度を上げてからでないと観察しずらい場合もある。そのための方法を紹介する。(注:培養器の底にいることの多い藻類や底性の繊毛虫,ミドリムシなどはマイクロピペットで底を這うように吸い取ればよい。とくに遠心などの操作は必要ない。)
ゾウリムシなど遊泳性ないし浮遊性の原生生物を観察する場合,実体顕微鏡(x40程度)ではたくさんいるように見えても,それらをそのままスライドガラスの上にのせて光学顕微鏡で拡大すると,細胞がほとんど視野の中に入らないことがある。そのような場合は,顕微鏡観察の前にはあらかじめ細胞を集める(=細胞密度を上げる)作業が必要になる。通常は,遠心機を用いて細胞を集めることが多い。細胞の大きさやその運動性にもよるが,卓上型低速遠心機で500〜1000 rpm程度の回転速度を用いる。あまり高速だと遠心力が強すぎて細胞がダメージを受ける恐れがある。逆に,低速すぎても細胞が沈澱しないので,各生物ごとに適当に速さを加減する。
|
| もどる | 目 次 | すすむ |
| 原生生物の採集と観察 |