
生きた細胞内の封入体(大核内の油的状の構造)

生きた細胞内の封入体(大核内の油的状の構造)
ただし,クロマチン成分を膨潤させて,封入体だけを残す方法を採用したのだが,こうすると,内部の顆粒成分(ここに核酸があると思われる)も,膨潤してしまうため,封入体をよりきれいに単離しようとすればするほど,封入体内部の顆粒成分も溶出しやすくなり,なかなかうまくいかなかった。結局,いまのところ,封入体のタンパク質成分の解析はできているが,内部の核酸成分の単離には成功していない。
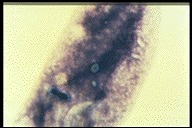
Azure C染色(封入体は染まらないが,内部に染色質があるのがわかる)
東洋ろ紙 No. 101
すじ入のロ−ト
つぎに,東洋ろ紙などで出している厚手のろ紙(東洋の場合は,NO. 101 )を,折り重ねないようにして,ろ紙にセットする。(折り重ねると,その隙間に細胞が集まり易くなり,挟まったまま大量死する危険がある。アコ−ディオン折りをするとよい)これに先の培養液を少しずつ入れていく。この時,液体がろ紙の下に落ちた後で,ろ紙の上に取り残された細胞が乾燥して死んでしまわぬように,ときどき洗浄ビンから水をふきつけて細胞を洗い流す。また,ろ紙の培養液透過速度を上げるためには,みぞ付のロ−トを用いるとよい。みぞがないと,ろ紙とロ−ト壁面が密着してしまい培養液透過速度が次第に低下する。約10分前後でフラスコ1〜2本分を100 ml 程度に濃縮できる。必要があれば,細胞が集まった後,ろ紙上で適当な緩衝液に置換することもできる。
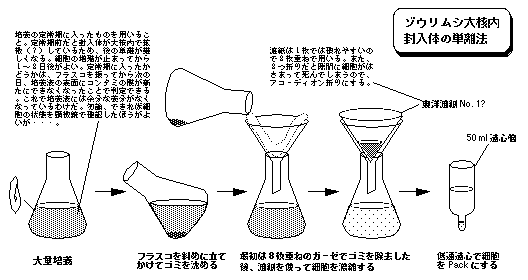
大核内封入体の単離
以上のようにして集められた細胞から,以下の方法でまず大核を分離し,つぎにその大核分画から封入体を単離する。
| 10 % | EtOH |
| 1 % | NP-40 |
| 5 mM | MgCl4 |
| 0.13 mM | CaCl2 |
| 0.25 M | sucrose |
| 10 mM | Tris-HCl(pH 7.0) |
核分画を得るには,上記の溶液と細胞のペレットを2〜3:1の割合でしずかに混合し,ゆるやかにピペッティングを行なう。約100回ほどピペッティングしたら,いったん低速( x 100 rpm?)で遠心して細胞を集め,今度は同じ溶液を入れて(4:1位),前よりは,やや強くピペッティングする。ふたたび, 低速で遠心を行ない大核を落とす。この操作を4〜5回繰り返すことで,ゆるやかな遠心で落ち難い大核より軽いペリクルやその他の断片,および細胞内の結晶成分などが除去されていく。Mg, Caは,上記の操作過程で大核が硬くなってピペッティング操作で壊れないようにする役目をもつ。
EtOH は通常の核の単離には用いないが,この場合はつぎのような理由で用いている。封入体は通常の条件で大核を単離し,それからさらに封入体を単離しようとすると,途中で著しく膨潤する性質をもつ。しかし,そこにEtOH があると封入体の膨潤を抑えることができるのである。ただし,あまり濃い濃度にすると当然固定が進んでしまうので,この10%程度がギリギリの値である。しかもこの10%のEtOH には以外な利点もある。
Mg, Caは,DNase の作用を活性化するので常温で上記の操作をすると大核DNAが分解してしまう。ところが,EtOH が入っていると DNaseの作用を押さえられるので分解を阻害することができる。そのため,上記の条件では室温で行なっても核のDNAを分解させずに回収することができる。
(しかし,EtOH のため細胞がやや固定されるので,上記のように,ピペッティングをすばやく何度か繰り返す必要がでてくる。)

単離大核(大きな封入体を含んでいる;内部に染色質があるのに注目)
つぎに,そのようにして得られた大核から,封入体を単離する方法を以下に示す。
まず,封入体の核酸以外の成分を調べる場合は,DNAが分解しないまま残っていると以下の操作をする上で大変じゃまになりときにはうまく単離出来ないことにもなりかねないので,通常は最後の遠心により得られた大核のペレットを10 mM Tris-HCl (pH 7.0) で1〜2度洗う。
これにより今度は,Mg, Caが入っておらず逆にEDTAにより2価イオンがキレ−トされるので,大核クロマチンは次第に膨潤し溶けだしていく。しかし,封入体はこの条件でも膨潤しない。そのため,封入体だけを遠心で沈澱させることができる。
ただし,pHが中性に戻っている点に注意。この条件下でも10% EtOHのおかげてクロマチンDNAは分解しない。しかし,先にも述べたように,顆粒状の成分が含まれる封入体の内部は,大核クロマチンとともに膨潤してしまうので,適当なところで,処理を調整する必要がある。
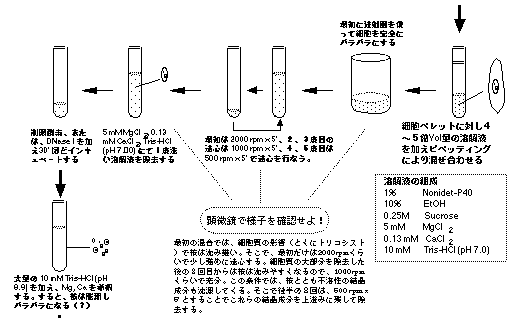

封入体の単離法
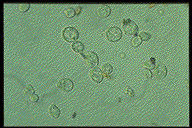
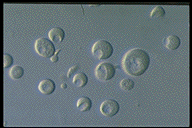
単離封入体
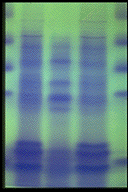
単離封入体のSDS-PAGE 両側は封入体
結果;
塩溶液
抗生物質
その他の試薬
温度
栄養条件
その中で,以下の条件で特異な反応が見られた。
条件:
5%DMSO,10℃で細胞を2〜3時間以上処理すると,
大核内の封入体が分散型となり,ついには
大核の外に出てしまったかのような状態になる。