Stentor pyriformisの研究
ビーカーによる培養法の開発
2017.09.09 撮影
ビーカーによる培養法(2017.09.17):
大量の細胞を1つの容器で培養できるのでメンテナンス作業が楽になる。
シャーレ培養に比べて,水深があるので,S.pyriformis各細胞に対して十分な量の水を与えることができる。
そのため,水質の劣化が遅くなる。これは野外の生息環境により近い状態といえる。
これだと(あくまでコンタミが少ない場合にかぎるが),頻繁に培養の世話(培養液の交換など)をしなくてよくなる(はず)。
ガラス(PYREX)とプラスチックの違い。ガラスの方がS.pyriformisには良さそう(まだ印象でしかないが)。
作業要領:
まだ無菌培養にはなっていないので,数日たつと雑菌やコンタミ藻が増えてくる。
その際は,ビーカーの中身を大型シャーレに移してそれらを取り除く。
S.pyriformisが底に沈んでいる場合は,一旦,全体をかき混ぜて,S.pyriformisがふたたび底に沈んだのを
確認した後,すみやかにコンタミ類が多く踏まれる上部を捨て,底に残ったS.pyriformisをシャーレに移す。
移した後は,シャーレでの培養と同様,駒込ピペットを使って徹底的にコンタミ類を取り除く。
作業が終った後,S.pyriformisをビーカーに戻し,新鮮な培養液(水耕栽培用の液肥=塩溶液)を加える。
S.pyriformisにとっては
水質の劣化(酸欠,注,無機塩類の減少,老廃物の蓄積,雑菌・コンタミ藻の増加)
がなにより問題なので,雑菌やコンタミ藻(有害なものが多い)を取り除く作業とともに
培養液の交換が重要。
シャーレに移して行う雑菌やコンタミ藻の除去作業は時間がかかるが,これをする余裕のない時でも,
培養液の交換だけならすぐに終るので,培養液の交換はできるかぎり頻繁に行うのが望ましい。
その際,上記のかき混ぜてから上部を捨てる作業を加えるだけでも,ある程度は雑菌・コンタミ藻の除去はできる。
注:細胞数が増えてくると,当然ながら酸欠が起こりやすくなる(後出)。
これまでの様子をみると,酸欠気味になると,細胞の一部がビーカーの上へ移動するように見える。
そのような状態になった際には,極力早めに培養液の交換を行い,酸欠状態を解消する。
現在行っているビーカーによる培養,xx:xx
1枚目:カラーボックス内にあるもの。
田代山湿原2017.7.9と横田代1157のバッチを3種類の液肥(水耕栽培用のエコゲリラとハイポニカ;
一般的な液肥であるハイポネックス,注)で培養中。
2枚目:窓際にあるラック(中段)にあるもの。
八幡平1204,八幡平1331,栂平1355 の各バッチを上記の液肥で培養中。
注:ハイポネックスは,水耕栽培用ではなく土壌栽培の際の補助栄養素として販売されている。
そのため,土壌にもともと多く含まれる無機塩類は含まない(ないし,少ない?)。
替りに,ビタミン類が含まれるので,その分,有機質が多く,バクテリア等が増えやすい。
一方,水耕栽培用として売られている液肥(エコゲリラ&ハイポニカ)は,
土壌のない状態での培養を目的としているので,土壌に多く含まれる無機塩類が添加されている。
反対にビタミンなどの有機質は含まない(はず,あくまで推測だが)。


2日後(2017.09.19)の様子
一部(横田代1157,八幡平1331)を 200 mlのビーカーから 500 mlのビーカーに移し換えた。
その際,当然ながら,いったん培養液をシャーレに移し,細胞以外のコンタミ(増殖したバクテリア;微細藻類はほぼゼロ)
を徹底的に除去し,新鮮な培養液(水耕栽培用の液肥)に換えてから新しい500mlビーカーに移した。




田代山湿原 2017.7.9,xx:xx
月井栄三郎氏による採集(2017.7.9)。
田代山湿原のものはシャーレによる培養を経ずに,採集サンプルをそのままビーカーへ移して培養している。
200mlビーカーの底を撮影。
田代山湿原は尾瀬/日光地域に属する。
田代山湿原 2017.7.9は,同じ地域にある横田代から採集された横田代1157と同様,
液肥+光の培養条件でよく増えている。

横田代1157,xx:xx
1枚目:これは,シャーレによる培養で増えたものをビーカーに移した。
2枚目:ビーカーの底の様子。横田代1157は細胞が大きい。数も多いので,このように多くの細胞が集まって塊を作っている。
肉眼でも確認は容易。
3,4枚目:蓋(シャーレの底を利用)を撮って,ビーカーの上から撮影。
4枚目:ズーム。




横田代1157,一部をプラスチックシャーレに移して撮影,xx:xx


横田代1157,デジカメを近付けて顕微鏡モードで撮影,xx:xx
S. pyriformis 各細胞の大きさは,おおよそ 700μm(0.7mm)前後。
ゾウリムシ(Paramecium caudatum)の2倍以上ある。
ビーカーからシャーレに移してほどなく撮影したので,移した際の機械的刺激で典型的なラッパ形ではなくなっている。
多くの細胞は,移動している時の典型的な形(円錐形)をしてうごめいている。
しばらく静置してから撮影すれば,典型的なラッパ形になったはず(反省,次回)。
典型的なラッパ形の細胞は,上々段の「ビーカーの上から撮影」した画像に写っている。
この状態の時は,多くの場合,細胞はシャーレの底に付着して移動していない(まれにラッパ形のままで遊泳していることもある)。




横田代1157,顕微鏡モード+デジタルズーム撮影,xx:xx



横田代1157,xx:xx
1枚目:顕微鏡モード撮影。
2,3枚目:顕微鏡モード+デジタルズーム撮影。
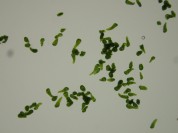


横田代1157,xx:xx
顕微鏡モード撮影。
 ←動画
←動画
窓際のラックにあるビーカーの1つを取り出し紙の上に置いて撮影,xx:xx
もう少し面積の広い紙の上に置くべきだった。絵的には失敗。



− 戻 る −

























